Zioła łagodzące kaszel suchy i mokry – ich mechanizmy działania, zastosowanie w fitoterapii oraz zasady bezpiecznego stosowania

Kaszel to jeden z najczęstszych objawów infekcji dróg oddechowych, który potrafi skutecznie uprzykrzyć codzienne funkcjonowanie. Choć jest mechanizmem obronnym, mającym oczyścić drogi oddechowe, zbyt nasilony może wymagać łagodzenia. Fitoterapia oferuje wiele roślin, które, w zależności od rodzaju kaszlu, działają osłaniająco, wykrztuśnie lub wspomagająco, łagodząc stan zapalny i ułatwiając regenerację błon śluzowych. Jakie rośliny tutaj znajdziemy? Jak je bezpiecznie stosować? Na co zwrócić uwagę?
Czym jest kaszel?
Kaszel to odruchowa, ochronna reakcja organizmu, która oczyszcza drogi oddechowe z wydzieliny i czynników drażniących, np. z pyłu czy patogenów. Powstaje na skutek pobudzenia receptorów czuciowych w drogach oddechowych, przewodzonych głównie przez nerw błędny do ośrodków pnia mózgu, a następnie przez włókna eferentne do mięśni oddechowych. U części chorych, zwłaszcza z kaszlem przewlekłym, dochodzi do nadwrażliwości z nadmierną aktywacją kanałów TRP. Nadmierna aktywacja kanałów TRP to stan, w którym receptory czuciowe w drogach oddechowych reagują zbyt silnie na bodźce, prowadząc do obniżenia progu kaszlowego i przewlekłej nadwrażliwości. To kluczowy mechanizm w przewlekłym kaszlu, opisywany w najnowszych wytycznych europejskich i amerykańskich.
W praktyce klinicznej wyróżnia się:
- Kaszel ostry (<3 tygodni) – towarzyszy najczęściej ostrym infekcjom wirusowym.
- Kaszel podostry (3-8 tygodni) – to często kaszel, który pojawia się po infekcji.
- Kaszel przewlekły (> 8 tygodni) – wymaga dokładniejszej diagnostyki, np. w kierunki astmy, nadreaktywności oskrzeli, zespołu UACS (Upper Airway Cough Syndrome, czyli zespołu kaszlu z górnych dróg oddechowych) i refluksu żołądkowo-przełykowego.
Kaszel można podzielić także na:
- Kaszel suchy – nieproduktywny, męczący bez odkrztuszania wydzieliny,
- Kaszel mokry – produktywny, z odkrztuszaną wydzieliną.
Niezależnie od terapii objawowej, obecność tzw. objawów alarmowych, np. krwioplucia, utraty masy ciała, wysokiej gorączki, duszności, spoczynkowej nietolerancji wysiłku, bólu w klatce piersiowej, powinna skłonić pacjenta do pilnej diagnostyki lekarskiej.
Kaszel – gdzie jest miejsce fitoterapii?
W łagodnych zakażeniach górnych dróg oddechowych i kaszlu ostrym bez objawów alarmowych zioła mogą zmniejszać objawy, skracać czas do pełnego ustąpienia kaszlu i poprawiać komfort życia. Wyróżnia się 3 główne mechanizmu działania surowców roślinnych, które determinują ich zastosowanie w kaszlu:
- Działanie powlekające (osłaniające),
- Działanie wykrztuśne/mukolityczne,
- Działanie przeciwzapalne, odkażające, immunomodulujące.
Poniżej znajdziesz przykłady surowców roślinnych, które są wykorzystywane w zwalczaniu kaszlu zgodnie ze swoim mechanizmem działania.
Zioła na kaszel – powlekające (osłaniające)
Polisacharydy śluzowe, które są obecne w surowcach roślinnych, tworzą bioadhezyjny film w błonie śluzowej gardła i krtani. Zmniejszają dzięki temu pobudliwość aferentnych włókien czuciowych, czego efektem są: zmniejszenie „drapania” w gardle, rzadsze napady kaszlu i poprawia komfortu życia. Wykorzystuje się to przede wszystkim w czasie kaszlu suchego.
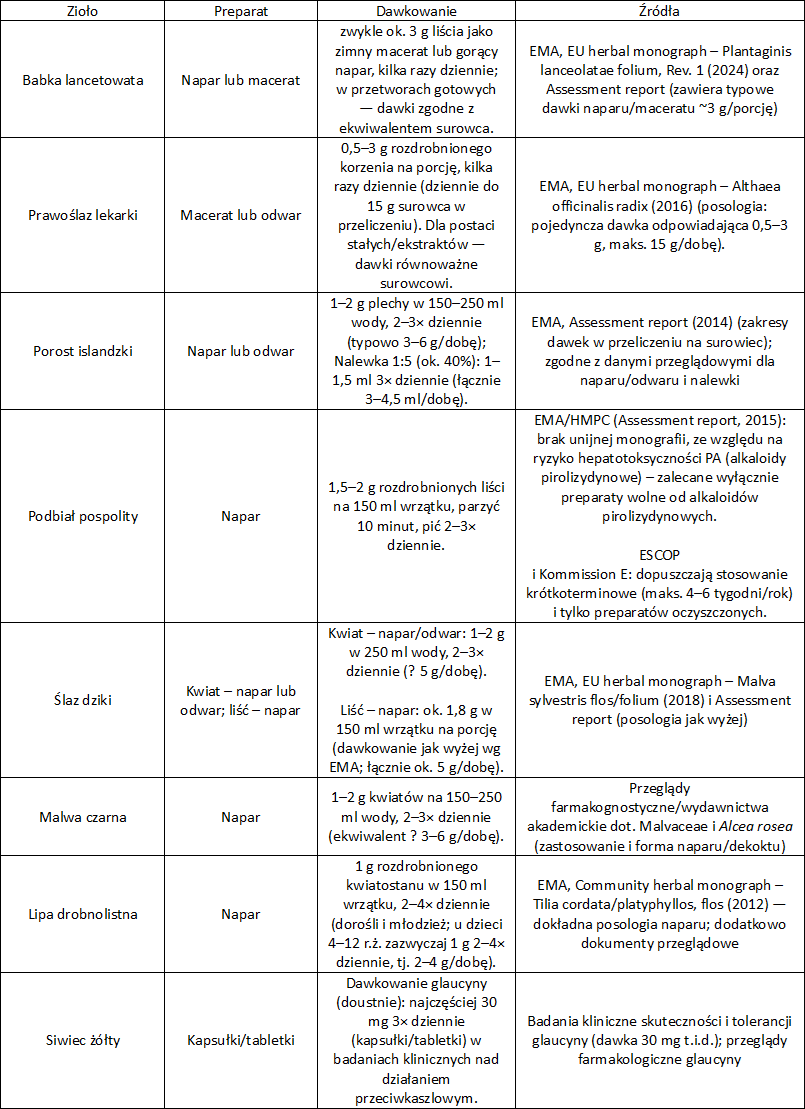
Babka lancetowata (Plantago lanceolata L.) – liść babki lancetowatej
Liść babki lancetowatej jest bogaty w polisacharydy śluzowe, irydoidy (aukubina) i flawonoidy. Mechanizm działania śluzów to tworzenie filmu ochronnego na błonach śluzowych, a dodatkowo może działać przeciwzapalnie. Monografia EMA (2024) podaje następujące wskazania do stosowania: podrażnienia jamy ustnej i gardła z towarzyszącym suchym kaszlem. Badania kliniczne potwierdzają poprawę objawów kaszlu u dzieci i dorosłych.
Prawoślaz lekarski (Althaea ofiicinalis L.) – korzeń prawoślazu, liść prawoślazu
Surowce zawierają do 20% śluzów. Wykazują silne działanie osłaniające i przeciwkaszlowe, zmniejszające wrażliwość receptorów kaszlowych. Monografia EMA (2016) podaje wskazania do stosowania: łagodzenie podrażnień jamy ustnej i gardła związanych z suchym kaszlem. Potwierdzony w badaniach klinicznych jako skuteczny demulcens (działanie powlekające).
Płucnica/Tarczownica islandzka, Cetraria islandica L.) – porost islandzki (Lichen islandicus)
Porost islandzki zawiera polisacharydy śluzowe (licheninę, izolicheninę) i kwasy porostowe. Działają one powlekająco i łagodząco, dodatkowo łagodne działanie przeciwbakteryjne. Monografia EMA (2014) podaje wskazania do stosowania: suchy kaszel i podrażnienie jamy ustnej/gardła. Jest powszechnie stosowany w pastylkach na kaszel suchy.
Podbiał pospolity (Tussilago farfara L.) – liść podbiału
Surowiec zawiera śluzy, flawonoidy i kwasy fenolowe, dzięki czemu wykazuje działanie powlekające i łagodzące kaszel. Jest tradycyjnie stosowany w suchym kaszlu, ale obecnie rzadko zalecany ze względu na zawartość alkaloidów pirolizydynowych (PA) o działaniu hepatotoksycznym – stosuje się wyłącznie preparaty oczyszczone z PA.
Ślaz dziki, zaniedbany (Malva sylvestris L.) – liść/kwiat ślazu
Liść czy kwiat ślazu zawierają do 10% śluzów, a także antocyjany i flawonoidy. Mechanizm działania polega na osłonie i zwalczaniu stanów zapalnych błon śluzowych gardła i krtani. Dane farmakognostyczne (m.in. „Farmakognozja” Kohlmunzera) i monografie ESCOP wskazują go jako środek tradycyjnie stosowany w suchym kaszlu i chrypce.
Malwa czarna (Althaea rosea L.) – kwiat malwy czarnej
Surowiec śluzowy zbliżony do ślazu dzikiego i prawoślazu. Zawarte w nim polisacharydy śluzowe redukują podrażnienia gardła, zmniejszają odruch kaszlowy. Malwa czarna jest tradycyjnie stosowana w fitoterapii infekcji górnych dróg oddechowych.
Lipa drobnolistna (Tilia cordata L.) – kwiatostan lipy
Kwiatostan lipy zawiera polisacharydy śluzowe, flawonoidy i olejek eteryczny. Śluzy działają osłaniająco i przeciwkaszlowo, flawonoidy łagodnie przeciwzapalnie, a napar działa też napotnie w infekcjach. Lipa jest tradycyjnie stosowana przy kaszlu towarzyszącym przeziębieniom. Jej działanie zostało potwierdzone w monografiach ESCOP i literaturze farmakognostycznej.
Zioła przeciwkaszlowe o innym mechanizmie
Siwiec żółty (Glaucium flavum L.) – ziele siwca żółtego
Surowiec zawiera alkaloidy izochinolinowe, z których najważniejsza jest glaucyna. Obecne są też m.in. chelidonina, protopina i sangwinaryna. Glaucyna działa ośrodkowo. Hamuje ośrodek kaszlu w rdzeniu przedłużonym, nie powodując przy tym depresji oddechowej. Wykazuje dodatkowo działanie rozkurczowe na mięśnie gładkie oskrzeli i właściwości przeciwzapalne. Jest tradycyjnie stosowany jako roślinny środek przeciwkaszlowy. Skuteczność glaucyny potwierdzono w badaniach klinicznych, gdzie działanie było porównywalne do kodeiny, przy korzystniejszym profilu bezpieczeństwa.
Zioła na kaszel – wykrztuśne, mukolityczne, sekretolityczne
Działanie wykrztuśne ziół na kaszel polega na tym, że zwiększają one ilość, rozrzedzają lub zmieniają właściwości wydzieliny oskrzelowej, a także wpływają na aktywność nabłonka rzęskowego, dzięki czemu łatwiej ją usunąć.
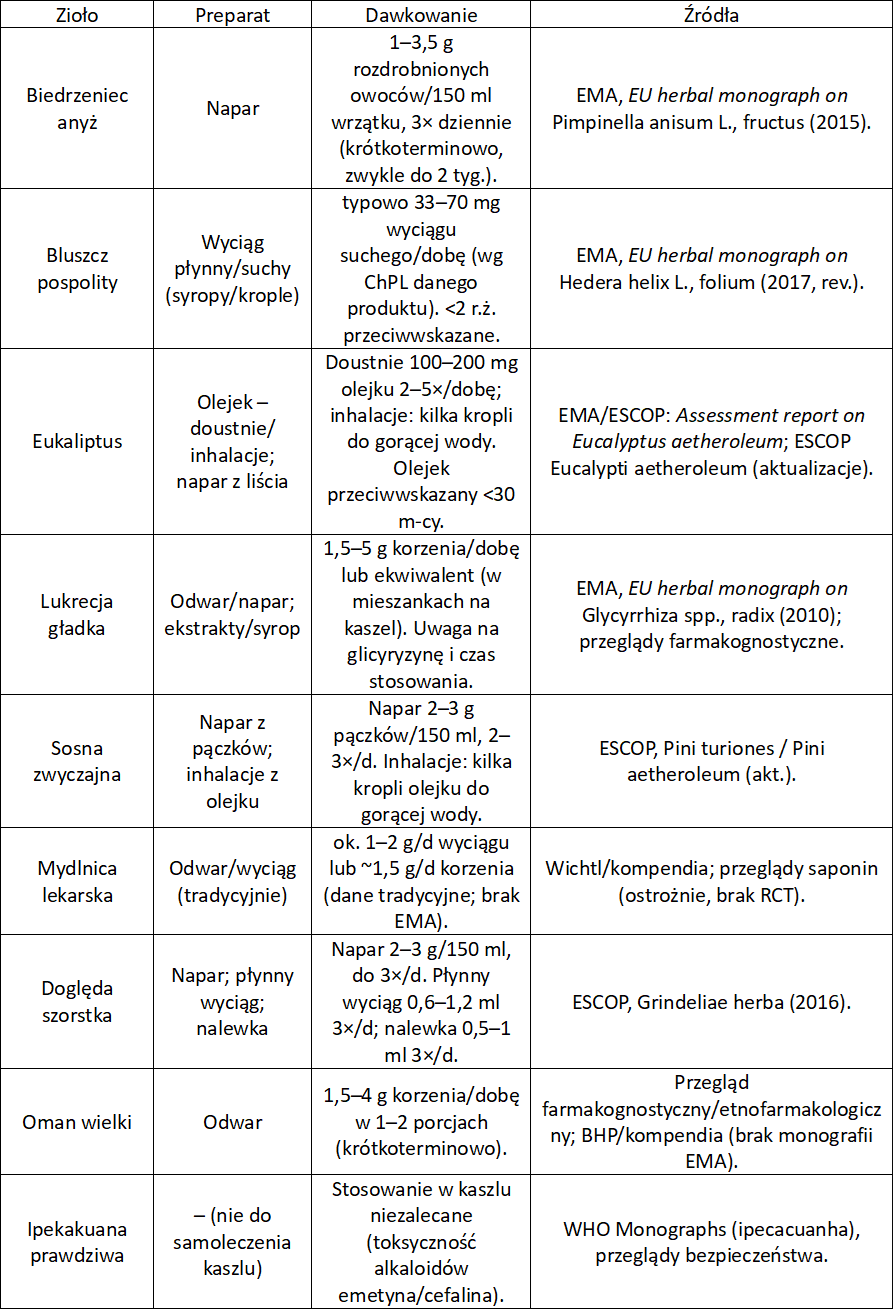
Bluszcz pospolity (Hedera helix L.) – liść bluszczu
Bluszcz zawiera saponiny triterpenowe (hederakozyd, który przekształca się w α-hederynę). α-Hederyna hamuje internalizację receptorów β₂ przez co wzmacnia ich sygnalizację, a to doprowadza do rozkurczu oskrzeli i zwiększenia płynnej wydzieliny. Monografia EMA wskazuje na stosowanie w kaszlu produktywnym.
Eukaliptus (Eucalyptus spp.) – olejek eukaliptusowy
Zawiera olejek eteryczny bogaty w 1,8-cyneol (eukaliptol). Zwiększa on uwodnienie i transport śluzu łagodnie zmieniając też skład wydzieliny. Dodatkowo może działać przeciwzapalnie.
Monografia EMA wskazuje na tradycyjne stosowanie w kaszlu i przeziębieniu. Badania kliniczne z wykorzystaniem 1,8-cyneolu w ostrym zapaleniu oskrzeli wykazały zmniejszenie objawów.
Biedrzeniec anyż (Pimpinella anisum L.) – owoc anyżu
Owoc i olejek zawierają głównie trans-anetol (80–90%), a także anisaldehyd i niewielkie ilości estragolu. Trans-anetol działa drażniąco na błonę śluzową żołądka, co poprzez odruch nerwu błędnego prowadzi do zwiększenia wydzielania wodnistej frakcji śluzu w drogach oddechowych. Dzięki temu gęsta wydzielina ulega rozcieńczeniu, staje się łatwiejsza do odkrztuszenia, a kaszel produktywny jest bardziej efektywny. Olejek eteryczny wykazuje także łagodne działanie przeciwbakteryjne i spazmolityczne. Monografia EMA (2015) obejmuje tradycyjne wskazania do stosowania w łagodnych dolegliwościach trawiennych i w kaszlu związanym z przeziębieniem.
Lukrecja gładka (Glycyrrhiza glabra L.) – korzeń lukrecji
Korzeń lukrecji zawiera do 15% saponin triterpenowych, z których najważniejsza jest glicyryzyna, a także flawonoidy (likwirytygenina, izolikwirytygenina). Saponiny zwiększają wydzielanie wodnistej, rzadszej wydzieliny w drogach oddechowych, co ułatwia rozcieńczenie i usuwanie zalegającego gęstego śluzu. Jednocześnie glicyryzyna i flawonoidy hamują mediatory zapalne w błonie śluzowej, co zmniejsza jej podrażnienie i łagodzi odruch kaszlowy. EMA (2010) potwierdza tradycyjne stosowanie w kaszlu produktywnym i w łagodzeniu podrażnień błon śluzowych górnych dróg oddechowych.
Sosna zwyczajna (Pinus sylvestris L.) – młode pędy sosny
Młode pędy sosny i i olejek eteryczny zawierają α- i β-pinen, limonen oraz borneol. Olejek eteryczny drażni błonę śluzową żołądka, co odruchowo zwiększa wydzielanie wodnistego śluzu w drogach oddechowych. Dodatkowo lotne składniki inhalowane działają antyseptycznie i łagodnie mukolitycznie. Takie działanie potwierdza Blaschek W, et al. Hagers Enzyklopädie der Arzneistoffe und Drogen. 6th ed. Stuttgart: Springer; 2015 jako tradycyjne zastosowanie w kaszlu i infekcjach dróg oddechowych.
Mydlnica lekarska (Saponaria officinalis L.) – korzeń mydlnicy
Korzeń mydlnicy zawiera do 5% saponin triterpenowych (saponariozydy A i B). Saponiny drażnią błonę śluzową żołądka, co odruchowo zwiększa wydzielanie wodnistego śluzu w oskrzelach. Dzięki temu gęsta wydzielina ulega rozcieńczeniu i łatwiej się odkrztusza, jednak w wyższych dawkach surowiec może wywoływać nudności. Potwierdzenie tych działań można znaleźć u Blaschek W, et al. Hagers Enzyklopädie der Arzneistoffe und Drogen. 6th ed. Stuttgart: Springer; 2015, gdzie opisane są właściwości wykrztuśne i ograniczenia bezpieczeństwa.
Doględa szorstka (Grindelia squarrosa Pursh.) – ziele grindelii
Ziele zawiera żywice bogate w kwasy diterpenowe (m.in. kwas grindelowy), olejek eteryczny (borneol, α-pinen, limonen) oraz flawonoidy. Diterpeny i olejek eteryczny pobudzają wydzielanie wodnistej frakcji śluzu w oskrzelach, a flawonoidy i żywice działają przeciwzapalnie, łagodząc obrzęk i podrażnienie błon śluzowych dróg oddechowych. ESCOP (European Scientific Cooperative on Phytotherapy. ESCOP Monographs: Grindeliae herba. Stuttgart: Thieme; 2016) potwierdza jej tradycyjne stosowanie w kaszlu produktywnym towarzyszącym przeziębieniu.
Oman wielki (Inula helenium L.) – korzeń omanu
Korzeń omanu wielkiego zawiera saponiny, laktony seskwiterpenowe (alantolakton, izoalantolakton) oraz olejek eteryczny. Saponiny zwiększają wydzielanie wodnistego śluzu w oskrzelach, a olejek nasila odruch kaszlowy. Z kolei laktony seskwiterpenowe działają przeciwzapalnie i przeciwbakteryjnie, co dodatkowo wspiera oczyszczanie dróg oddechowych. Potwierdzenie tych działań znajdziemy w pracy Obolskiy D, Pischel I, Feistel B, Glotov N, Heinrich M. Inula helenium L. – a review on ethnopharmacological and phytochemical aspects. J Ethnopharmacol. 2011;137(1):1-19 – opisuje tradycyjne stosowanie w chorobach układu oddechowego i potwierdza właściwości sekretolityczne.
Ipekakuana prawdziwa, wymiotnica prawdziwa (Carapichea ipecacuanha (Brot.) L. Andersson) – korzeń wymiotnicy, ipekakuany
Korzeń zawiera alkaloidy izochinolinowe, głównie emetynę i cefelinę. W małych dawkach alkaloidy drażnią błonę śluzową żołądka, co przez odruch nerwu błędnego zwiększa wydzielanie wodnistego śluzu w oskrzelach i ułatwia jego odkrztuszanie. W wyższych dawkach surowiec działa emetycznie, czyli wywołując wymioty. Potwierdzenie tych właściwości można znaleźć u White CM. Ipecac syrup: past uses, current status, and future directions. Ann Pharmacother. 2020;54(5):514-22. Udowadnia mechanizm odruchowy i opisuje historyczne zastosowanie w leczeniu kaszlu.
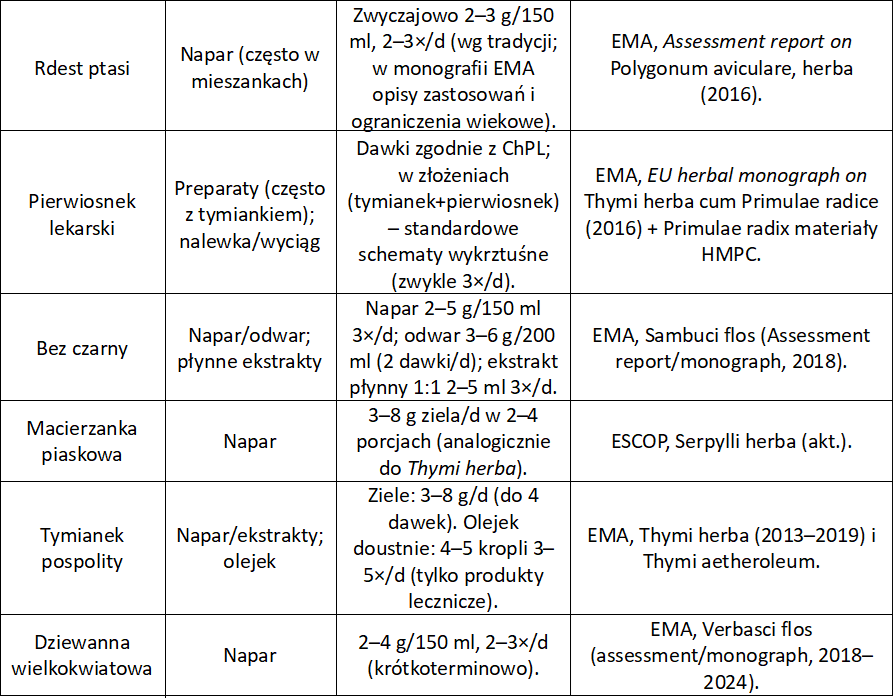
Rdest ptasi (Polygonum aviculare L.) – ziele rdestu
Ziele zawiera saponiny, flawonoidy (awikularyna, izoramnetyna), garbniki oraz krzemionkę. Saponiny zwiększają ilość wodnistej wydzieliny w drogach oddechowych, co rozcieńcza gęstą plwocinę i ułatwia jej odkrztuszanie. Flawonoidy z kolei działają przeciwzapalnie na błony śluzowe.
Potwierdzają to Opletal L, Jahodar L, Chodera A, et al. Planta medica and folk medicine of Polygonaceae. Phytother Res. 2001;15(5):415-21 w tradycyjnym zastosowaniu w chorobach układu oddechowego.
Pierwiosnek lekarski (Primula veris L.) – korzeń pierwiosnka
Korzeń pierwiosnka zawiera saponiny triterpenowe (primulina, primulakozydy) oraz fenolokwasy.
Saponiny drażnią błonę śluzową żołądka i odruchowo pobudzają gruczoły oskrzelowe do wydzielania wodnistego śluzu, który rozcieńcza gęstą wydzielinę i ułatwia jej odkrztuszenie. EMA (2010) potwierdza tradycyjne stosowanie pierwiosnka jako środka wykrztuśnego w kaszlu przeziębieniowym.
Bez czarny (Sambucus nigra L.) – kwiat bzu czarnego
Kwiat bzu zawiera flawonoidy (rutynę, izokwercytrynę), antocyjany i polisacharydy śluzowe. Śluzy działają powlekająco i łagodząco na błony śluzowe, a flawonoidy wspierają rozrzedzanie wydzieliny. Napar z kwiatu bzu działa napotnie i łagodnie wykrztuśnie, co wspiera oczyszczanie dróg oddechowych podczas infekcji. Monografia EMA (2012) potwierdza, że jest tradycyjnie stosowany w przeziębieniu przebiegającym z kaszlem.
Macierzanka piaskowa (Thymus serpyllum L.) – ziele macierzanki
Ziele zawiera olejek eteryczny (tymol, karwakrol, p-cymen) oraz flawonoidy. Olejek pobudza wydzielanie wodnistej frakcji śluzu w drogach oddechowych i stymuluje ruch rzęsek, co przyspiesza transport wydzieliny. Działa także przeciwbakteryjnie i łagodnie rozkurczowo.ESCOP (European Scientific Cooperative on Phytotherapy. ESCOP Monographs: Serpylli herba. 2nd ed. Stuttgart: Thieme; 2009) potwierdza tradycyjne stosowanie w kaszlu i nieżytach górnych dróg oddechowych.
Tymianek pospolity (Thymus vulgaris L.) – ziele tymianku
Ziele i olejek zawierają tymol, karwakrol, borneol i linalol. Olejek zwiększa wydzielanie wodnistego śluzu w drogach oddechowych, pobudza ruch rzęsek i działa antyseptycznie. W rezultacie wydzielina staje się rzadsza i łatwiejsza do odkrztuszenia. Monografia EMA (2013) potwierdza tradycyjne stosowanie tymianku jako środka wykrztuśnego. Skuteczność została też potwierdzona w badaniach klinicznych preparatów złożonych (tymianek + pierwiosnek).
Dziewanna wielkokwiatowa (Verbascum densiflorum L.) – kwiat dziewanny
Kwiat dziewanny zawiera polisacharydy śluzowe, saponiny i flawonoidy. Saponiny zwiększają ilość i płynność wydzieliny w oskrzelach, a śluzy powlekają błony śluzowe gardła, łagodząc podrażnienie i zmniejszając odruch kaszlowy. Monografia EMA (2011) potwierdza tradycyjne stosowanie dziewanny w bólu gardła i kaszlu związanym z przeziębieniem.
Zioła na kaszel – przeciwzapalne, przeciwwirusowe, immunomodulujące
Poniższej wymienione zioła to z kolei pewnego rodzaju „wspomagacze” leczenia kaszlu. Ich zadaniem jest wzmocnienie działania przeciwzapalnego, odkażanie czy pobudzenie układu odpornościowego do walki z infekcjami.
Działanie przeciwzapalne polega tutaj na hamowaniu aktywności enzymów prozapalnych (COX-2, LOX), przez co zmniejsza się produkcja cytokin i wolnych rodników, a jednocześnie stabilizuje się nabłonek dróg oddechowych. W efekcie zmniejsza się podrażnienie receptorów kaszlowych, obrzęk gardła i uczucie drapania.
Działanie antyseptyczne, czyli odkażające ma za zadanie wyeliminować drobnoustroje, których obecność może przedłużać czas infekcji i nasilać wydzielanie śluzu w drogach oddechowych. Zadaniem surowców roślinnych o właściwościach antyseptycznych jest uszkodzenie błon komórkowych drobnoustrojów, hamowanie przylegania bakterii do nabłonka i utrudnianie replikacji wirusów. Wynikiem jest redukcja patogenów w gardle czy oskrzelach, ograniczenie nadkażeń i przyspieszenie ustępowania infekcji. W tym skrócenie czasu trwania kaszlu.
Działanie immunomodulujące roślin polega na pobudzaniu aktywności makrofagów, neutrofili i komórek NK. Dodatkowo surowce te zwiększają produkcję interferonu oraz modulują wytwarzanie cytokin. Dzięki takiemu mechanizmowi dochodzi do szybszej eliminacji wirusów, mniejszej intensywności infekcji, skrócenia czasu trwania kaszlu, a także obniżenia ryzyka powikłań i przewlekłego podrażnienia dróg oddechowych.
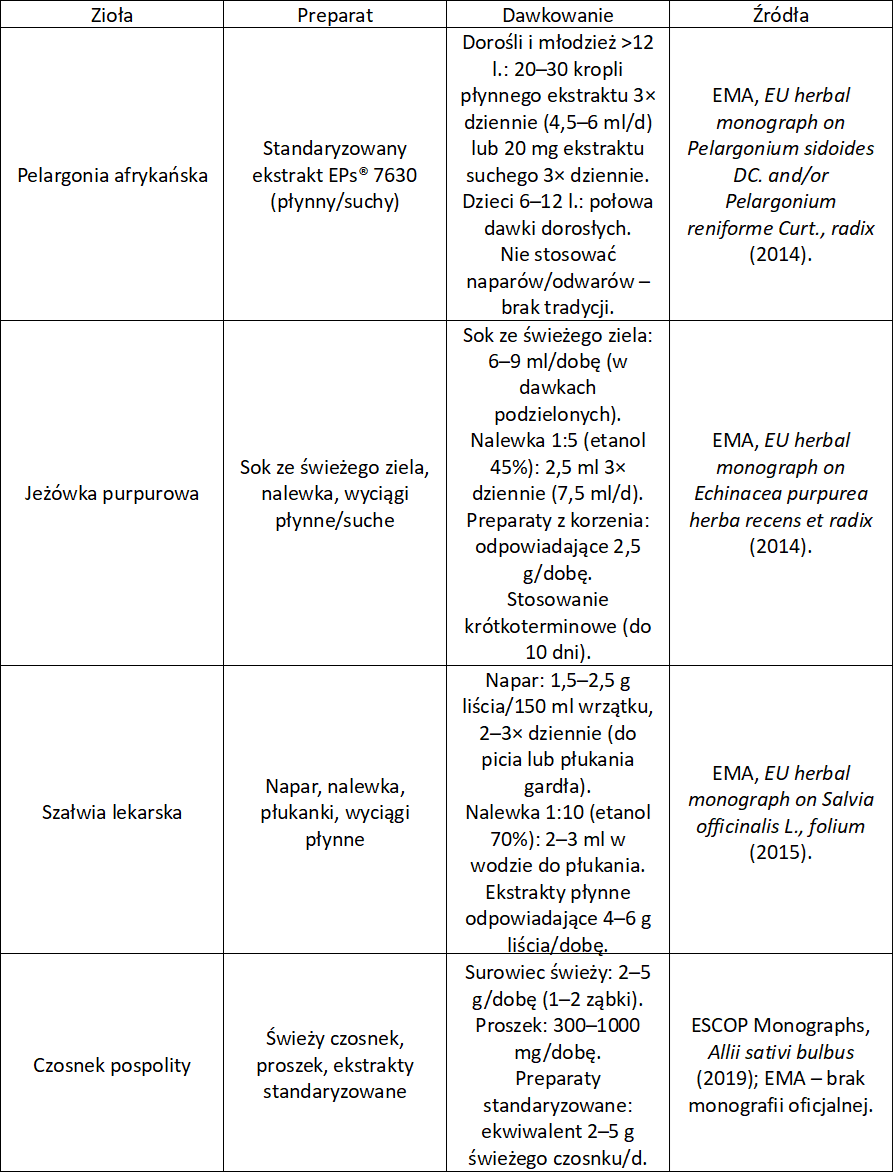
Pelargonia afrykańska (Pelargonium sidoides DC.) – korzeń pelargonii
Korzeń pelargonii zawiera kumaryny (umkalinę, skopoletynę), flawonoidy i kwasy fenolowe. Niektóre jego ekstrakty wodno-etanolowe stymulują nieswoistą odpowiedź immunologiczną, czyli aktywują makrofagi i zwiększają produkcję interferonu. Mają zatem właściwości przeciwwirusowe. Dodatkowo zmniejszają adhezję bakterii do nabłonka dróg oddechowych, co może znacząco ograniczyć nadkażenia. Monografia EMA (2014) wskazuje na tradycyjne stosowanie korzenia pelargonii w leczeniu ostrych infekcji dróg oddechowych. Liczne badania RCT z lat 2000-2020 potwierdziły z kolei skrócenie czasu trwania kaszlu u dzieci i dorosłych z ostrym zapaleniem oskrzeli.
Jeżówka purpurowa (Echinacea purpurea L.) – ziele i korzeń jeżówki
Korzeń i ziele jeżówki zawierają pochodne kwasu kawowego (echinakozyd, kwas cykoriowy), alkamidy i polisacharydy. Alkamidy i kwasy fenolowe modulują aktywność makrofagów i limfocytów zwiększając produkcję interferonu i cytokin przeciwwirusowych. Jednocześnie obniżają nadmierną odpowiedź zapalną. W kontekście kaszlu jeżówka wspiera szybszą eliminację patogenów i łagodzi stan zapalny błon śluzowych. Monografia EMA (2014) wskazuje na tradycyjne wykorzystanie jeżówki w leczeniu przeziębienia. Z kolei badania kliniczne wykazują skrócenie czasu trwania objawów infekcji, w tym kaszlu, u dorosłych.
Szałwia lekarska (Salvia officinalis L.) – liść szałwii
Liść szałwii zawiera olejek eteryczny (tujon, cyneol, kamforę), kwasy fenolowe (kwas rozmarynowy) i garbniki. Olejek ten działa antyseptycznie wobec bakterii i wirusów, a kwasy fenolowe i garbniki wykazują silne właściwości przeciwzapalne i ściągające. Podczas kaszlu surowiec łagodzi podrażnienia gardła, zmniejsza kolonizację bakteryjną i ogranicza miejscowy stan zapalny. Monografia (2015) wskazuje na tradycyjne zastosowanie szałwii w leczeniu zapalenia gardła i jamy ustnej oraz jako środek wspomagający w kaszl infekcyjnym.
Czosnek pospolity (Allium sativum L.) – cebula czosnek
Czosnek zawiera siarczki organiczne (allicynę, ajoen, S-allilo-L-cysteinę), flawonoidy, saponiny, śluzy i związki fenolowe. Wykazuje właściwości przeciwzapalne, przeciwwirusowe, przeciwbakteryjne i immunomodulujące. Działanie przeciwzapalne polega na hamowaniu aktywności COX-2 i LOX, przez co zmniejsza się produkcja cytokin prozapalnych i zmniejsza się stres oksydacyjny. Allicyna hamuje z kolei replikację wirusów (w tym rinowirusów i wirusa grypy) poprzez blokowanie enzymów i utrudnianie penetracji do komórek gospodarza. Siarczki czosnkowe mogą natomiast uszkadzać błony komórkowe bakterii i hamować ich enzymy. Wykazano aktywność wobec Streptococcus pneumoniae i Hemophilus influenzae, które są typowymi patogenami układu oddechowego. Śluzy zawarte w czosnku stymulują natomiast aktywność makrofagów i komórek NK wspomagając odpowiedź immunologiczną. Dzięki temu czosnek wspiera leczenie infekcji dróg oddechowych przebiegających z kaszlem. Może też skracać czas trwania przeziębienia i zmniejsza nasilenie objawów. Monografia EMA (2015) potwierdza jego tradycyjne wykorzystanie jako środka wspomagającego w przeziębieniach i infekcjach dróg oddechowych. Badania kliniczne potwierdzają z kolei zmniejszenie częstości przeziębień i skrócenie ich przebiegu dzięki suplementacji czosnkiem. Monografia ESCOP potwierdza działanie immunostymulujące i przeciwinfekcyjne.
Zioła na kaszel – jak stosować?
Zioła na kaszel – przeciwkaszlowe
Zioła na kaszel – wykrztuśne, mukolityczne, sekretolityczne
Zioła o działaniu przeciwzapalnym, antyseptycznym, immunomodulującym
Zioła na kaszel bezpieczeństwo stosowania
Zioła na kaszel – przeciwwskazania
Zioła przeciwkaszlowe
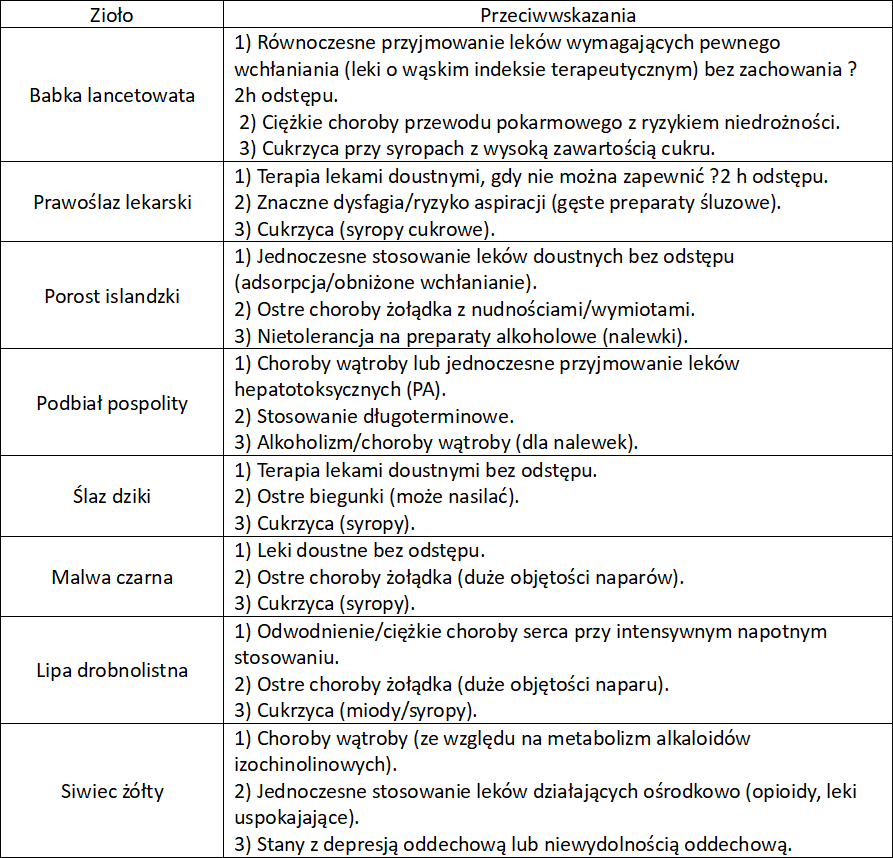
Zioła na kaszel wykrztuśne, mukolityczne, sekretolityczne
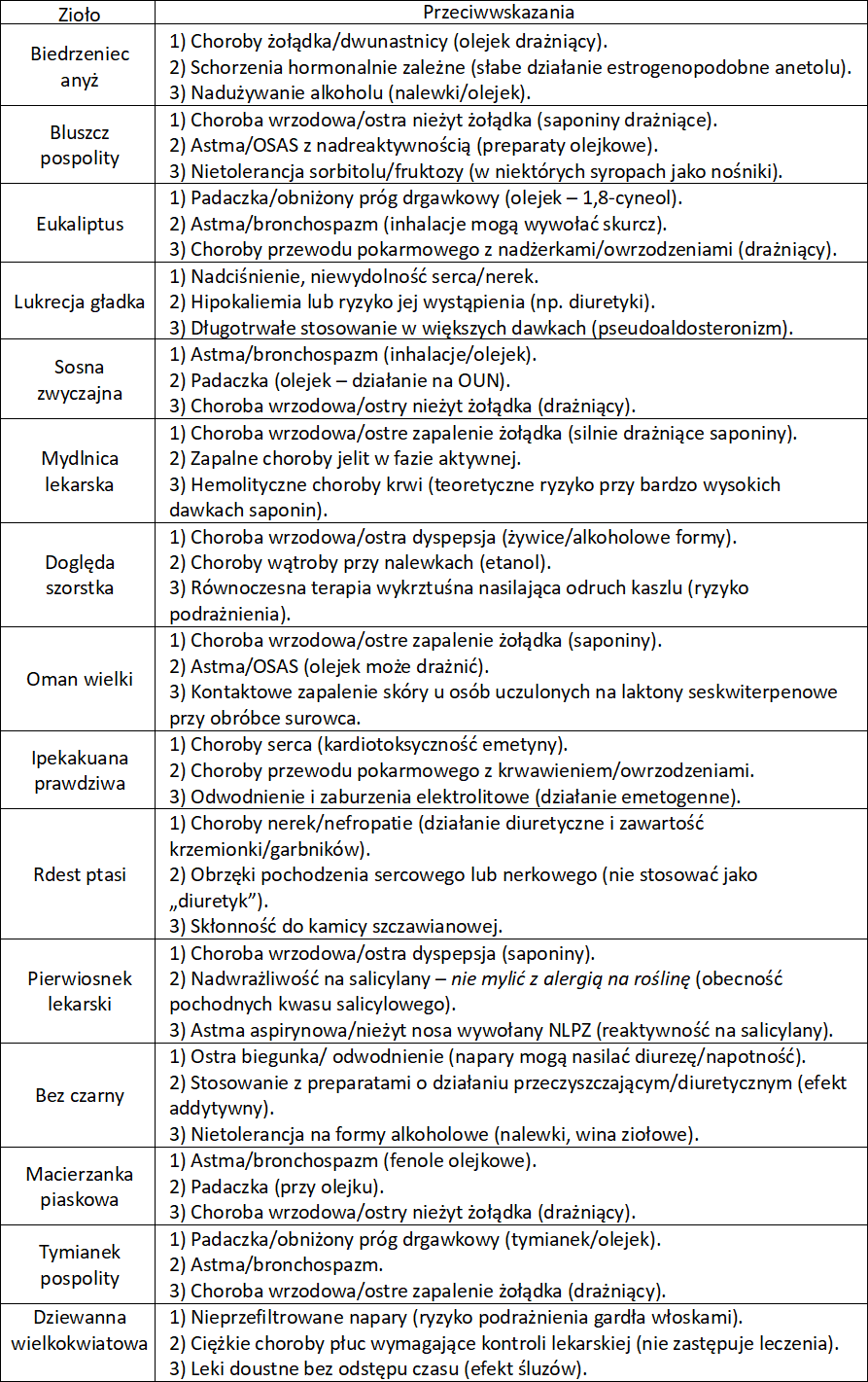
Zioła na kaszel – przeciwzapalne, antyseptyczne, immunomodulujące

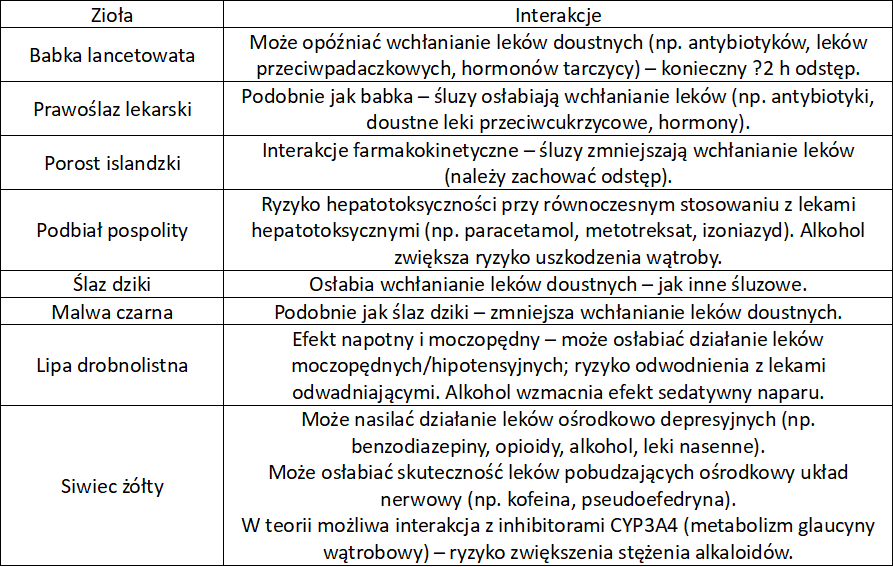
Zioła na kaszel – interakcje
Zioła przeciwkaszlowe
Zioła na kaszel – wykrztuśne, mukolityczne, sekretolityczne
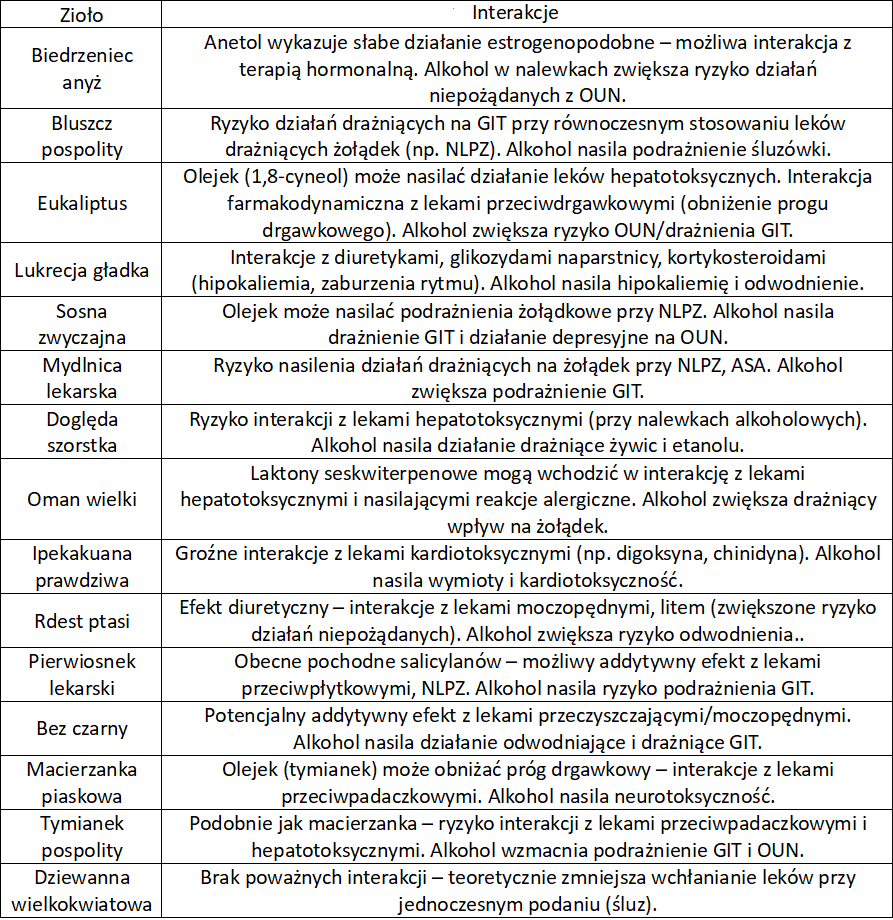
Zioła na kaszel – przeciwzapalne, antyseptyczne, immunomodulujące

Zioła na kaszel a dzieci
Ważna informacja. Niektórzy producenci preparatów zawierających poniższe surowce roślinne mogą podawać inny minimalny wiek, od którego można stosować dany produkt. Oznacza to, że bierze on odpowiedzialność za te informacje i ma potwierdzenie, co do bezpieczeństwa. Niemniej, poniżej przedstawiam zalecenia EMA, ESCOP czy też z ChPL.
Zioła przeciwkaszlowe
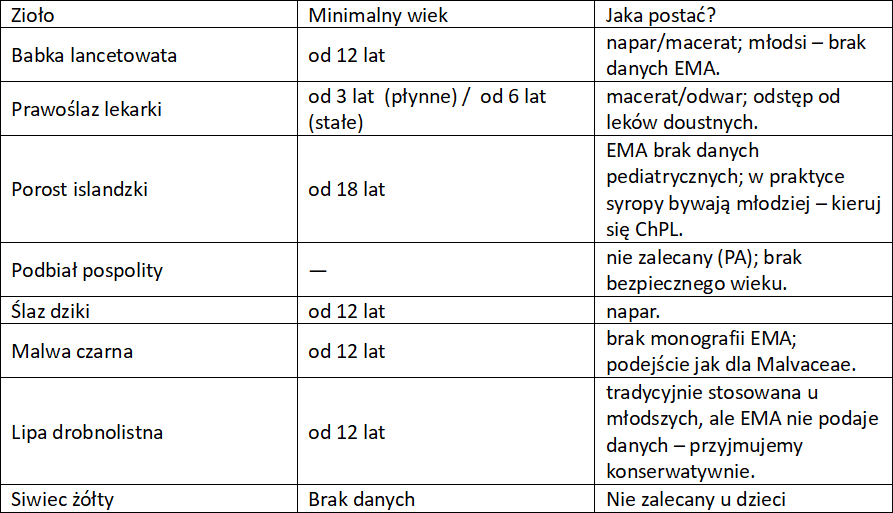
Zioła na kaszel – wykrztuśne, mukolityczne, sekretolityczne
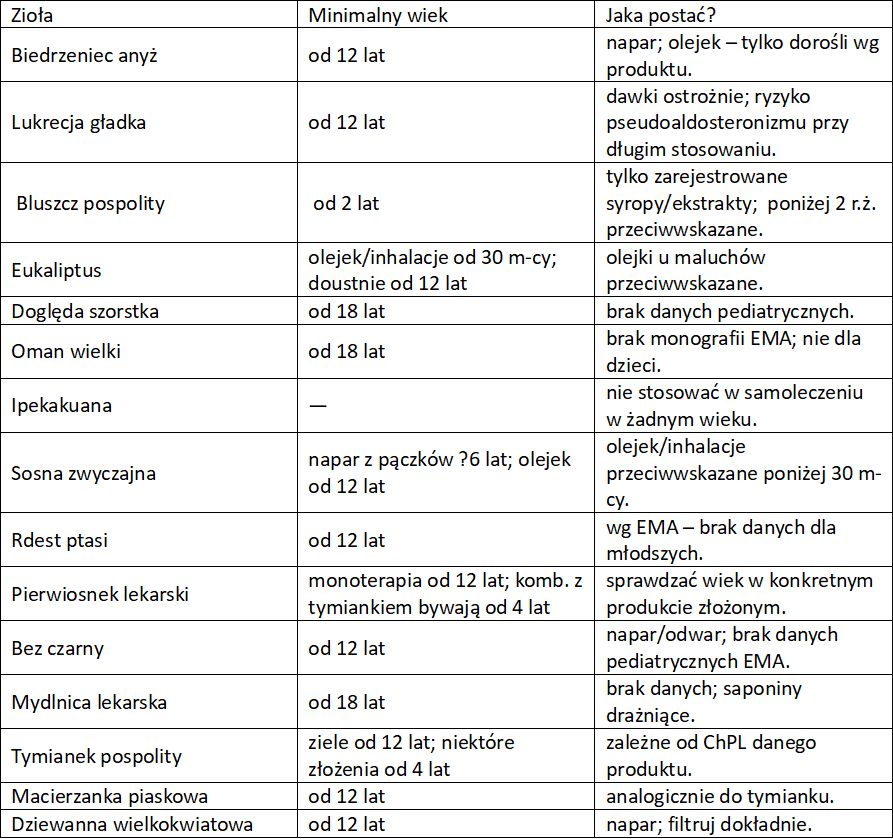
Zioła o działaniu przeciwzapalnym, antyseptycznym, immunomodulującym
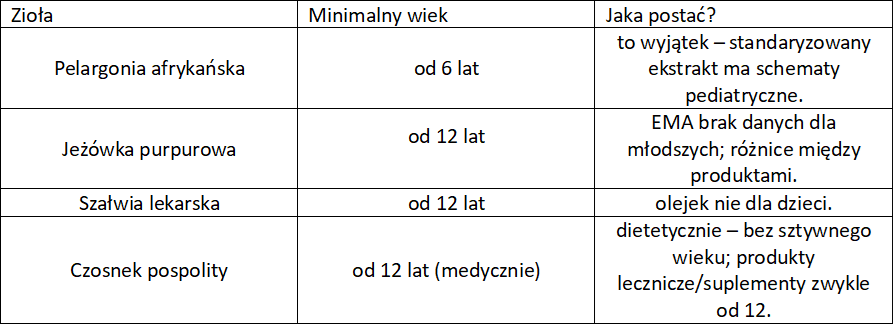
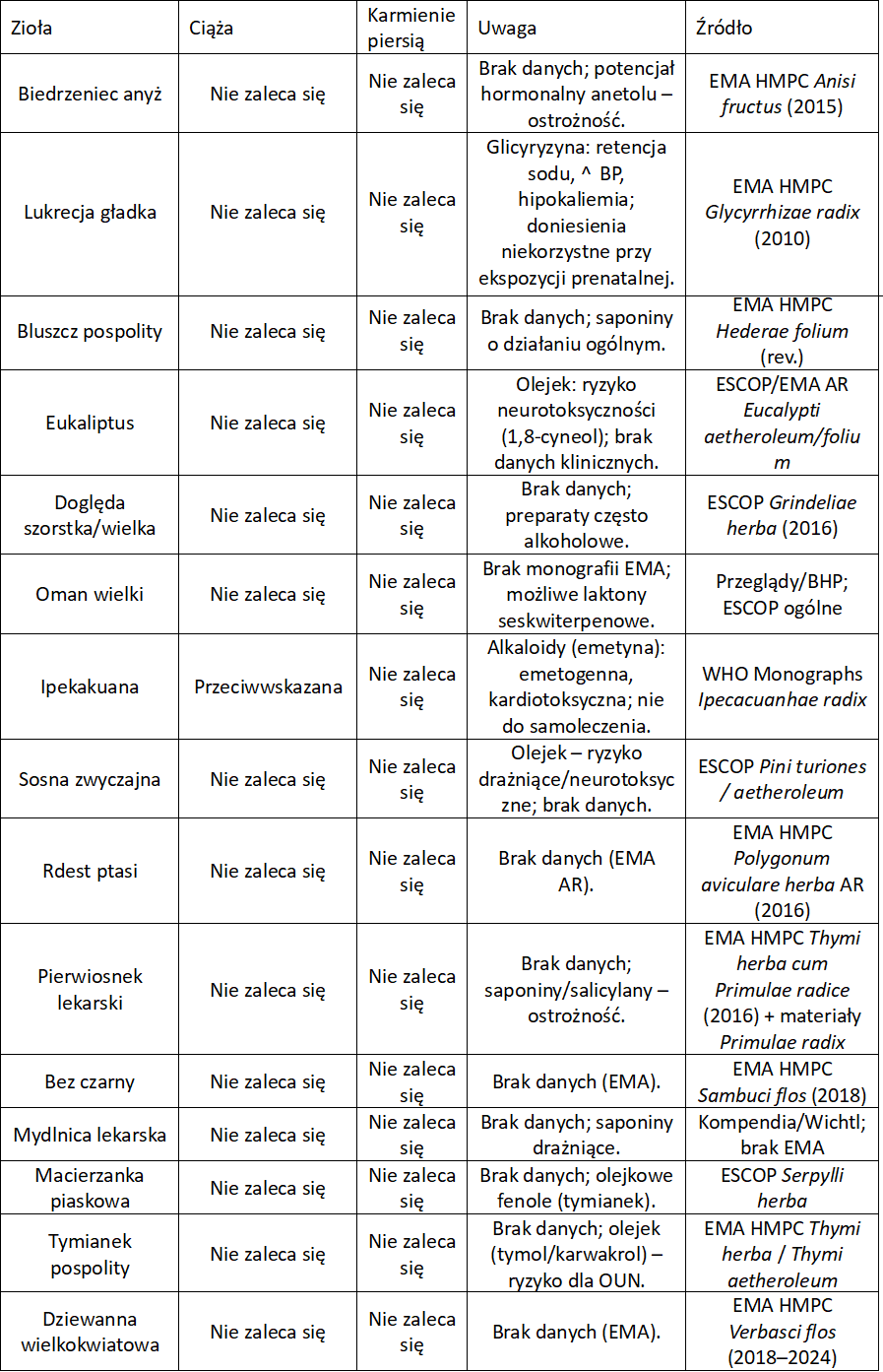
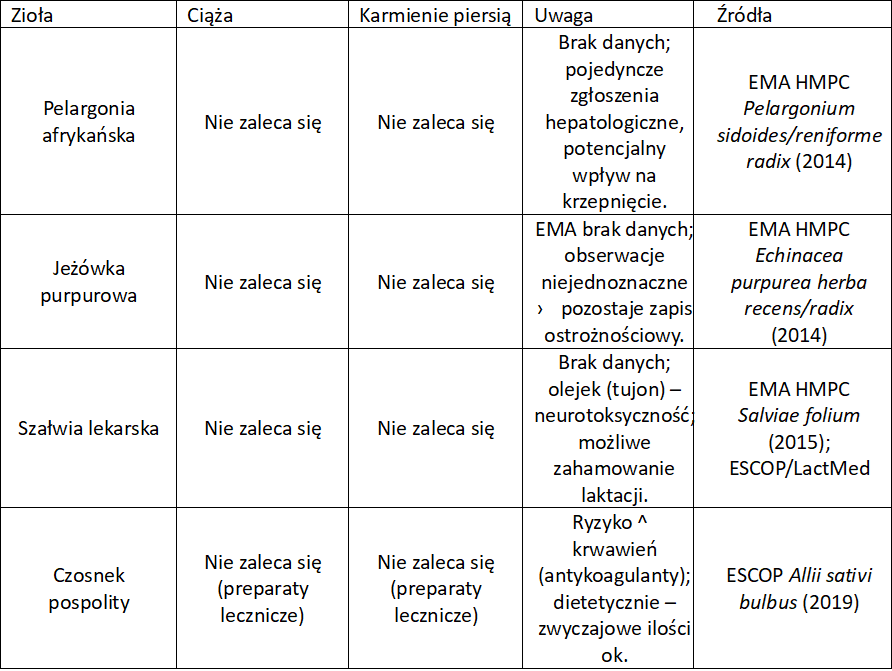
Zioła na kaszel w ciąży
W Unii Europejskiej standardem jest ostrożnościowy zapis: jeśli brak solidnych badań u ciężarnych/karmiących, EMA nie rekomenduje stosowania. To nie dowód szkodliwości, lecz zasada przezorności. Wyjątkiem jest podbiał (PA) i ipekakuana. Tu są realne powody toksykologiczne. Zawsze warto zwrócić uwagę na informacje podane przez producenta danego preparatu. Niektóre z nich są dedykowane właśnie kobietom w ciąży, choć na ogół zawierają surowce roślinne działające ogólnie w czasie przeziębienia.
Zioła przeciwkaszlowe
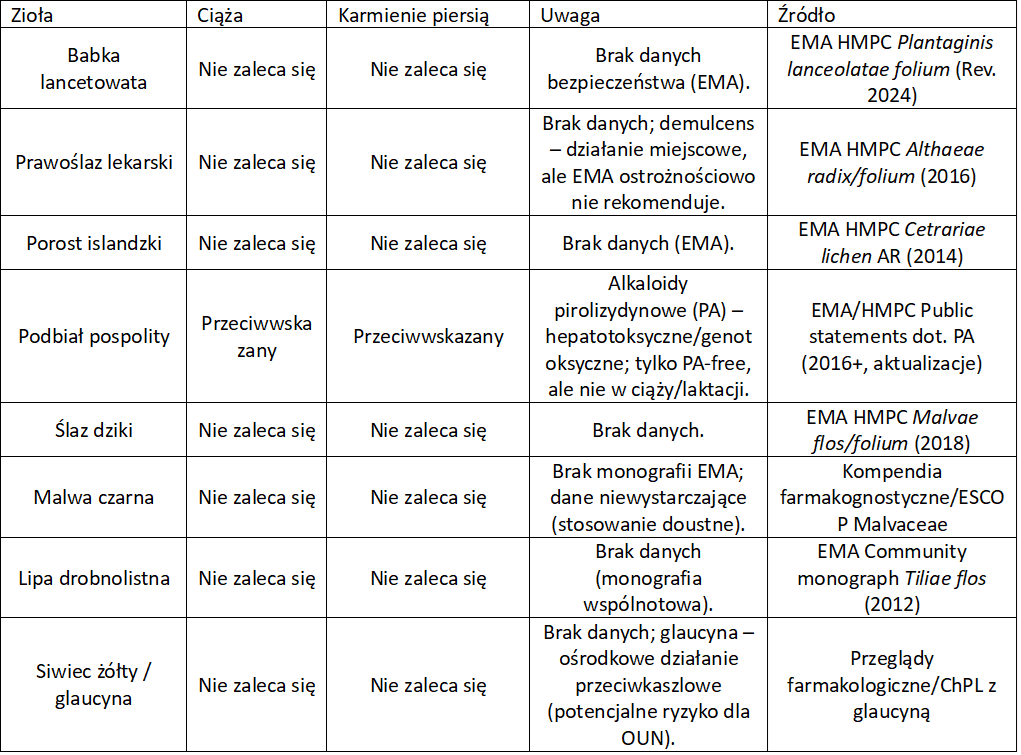
Zioła na kaszel – wykrztuśne, mukolityczne, sekretolityczne
Zioła o działaniu przeciwzapalnym, antyseptycznym, immunomodulującym
Z zielarskim pozdrowieniem

⚠️ Informacje w artykule mają charakter edukacyjny. Nie zastępują porady lekarskiej. Przed zastosowaniem ziół skonsultuj się z lekarzem lub farmaceutą.
Bibliografia
Morice AH et al. The diagnosis and management of chronic cough. Eur Respir J. 2020;55(1):1901136.
Song WJ, Chang YS, Faruqi S, et al. Defining chronic cough: a systematic review of the epidemiological literature. Allergy Asthma Immunol Res. 2016;8(2):146–155.
Canning BJ, Chang AB, Bolser DC, et al. Anatomy and neurophysiology of cough: CHEST Guideline and Expert Panel Report. Chest. 2014;146(6):1633–1648.
Chung KF, McGarvey L, Mazzone SB. Chronic cough as a neuropathic disorder. Lancet Respir Med. 2013;1(5):414–422
Morice AH. TRP channels and cough. Pulm Pharmacol Ther. 2021;68:102037.
Irwin RS, Madison JM. The diagnosis and treatment of cough. N Engl J Med. 2000;343(23):1715–1721.
Matthys H, Heger M. Efficacy and safety of herbal medicines in respiratory tract infections. Evid Based Complement Alternat Med. 2020;2020:1–15.
EMA. Guideline on the assessment of clinical efficacy of herbal medicinal products used in respiratory disorders. EMA/HMPC/138386/2014.
ESCOP. Guidelines for the Clinical Assessment of Herbal Medicinal Products. ESCOP; 2017.
EMA. Community herbal monograph on Althaea officinalis L., radix. EMA/HMPC/580187/2010.
EMA. Community herbal monograph on Plantago lanceolata L., folium. EMA/HMPC/471759/2016.
EMA. Community herbal monograph on Cetraria islandica (L.) Acharius s.l., thallus. EMA/HMPC/397439/2014.
EMA. Assessment report on Tussilago farfara L., folium/flos. EMA/HMPC/294963/2012.
EMA. Community herbal monograph on Glaucium flavum Crantz, herba. EMA/HMPC/354404/2014.
ESCOP Monographs. Tiliae flos. 2nd ed. Stuttgart: Thieme; 2003.
Kohlmünzer S (red.). Farmakognozja. Warszawa: PZWL; 2020.
Matławska I. Farmakognozja: podręcznik dla studentów farmacji. 1‑sze wydanie. Poznań: Uniwersytet Medyczny; 2005. ISBN 83‑60187
Ożarowski A, Jaroniewski W. Rośliny lecznicze i ich praktyczne zastosowanie. Warszawa: Instytut Wydawniczy Związków Zawodowych; 1987. ISBN 8320204720
Bisset NG, Wichtl M. Herbal Drugs and Phytopharmaceuticals. 4th ed. Stuttgart: Medpharm Scientific Publishers; 2016.
EMA. Community herbal monograph on Pimpinella anisum L., fructus. EMA/HMPC/137212/2015.
EMA. Community herbal monograph on Hedera helix L., folium. EMA/HMPC/607574/2012.
EMA. Community herbal monograph on Eucalyptus globulus Labill., folium. EMA/HMPC/200397/2013.
EMA. Community herbal monograph on Glycyrrhiza glabra L., radix. EMA/HMPC/571122/2010.
ESCOP Monographs. Grindeliae herba. 2nd ed. Stuttgart: Thieme; 2016.
Obolskiy D, Pischel I, Feistel B, Glotov N, Heinrich M. Inula helenium L. – a review on ethnopharmacological and phytochemical aspects. J Ethnopharmacol. 2011;137(1):1–19.
White CM. Ipecac syrup: past uses, current status, and future directions. Ann Pharmacother. 2020;54(5):514–522.
Opletal L, Jahodar L, Chodera A, et al. Planta medica and folk medicine of Polygonaceae. Phytother Res. 2001;15(5):415–421.
EMA. Community herbal monograph on Primula veris L., radix. EMA/HMPC/558185/2012.
EMA. Community herbal monograph on Sambucus nigra L., flos. EMA/HMPC/44240/2012.
ESCOP Monographs. Serpylli herba. 2nd ed. Stuttgart: Thieme; 2009.
EMA. Community herbal monograph on Thymus vulgaris L. and Thymus zygis L., herba. EMA/HMPC/342334/2013.
EMA. Community herbal monograph on Verbascum densiflorum L., flos. EMA/HMPC/136583/2011.
Blaschek W et al. Hagers Enzyklopädie der Arzneistoffe und Drogen. 6th ed. Stuttgart: Springer; 2015.
Bradley PR (ed.). British Herbal Compendium. Vol. 2. Bournemouth: BHMA; 2013.
EMA. Community herbal monograph on Pelargonium sidoides DC. and/or Pelargonium reniforme Curt., radix. EMA/HMPC/281599/2014.
EMA. Community herbal monograph on Echinacea purpurea (L.) Moench, herba et radix. EMA/HMPC/557963/2014.
EMA. Community herbal monograph on Salvia officinalis L., folium. EMA/HMPC/150848/2015.
ESCOP Monographs. Allii sativi bulbus. 2nd ed. Stuttgart: Thieme; 2019.
Ríos JL, Recio MC. Medicinal plants and antimicrobial activity. J Ethnopharmacol. 2005;100(1–2):80–84.
Zhai XF, et al. Clinical efficacy of Pelargonium sidoides extract in respiratory infections: a systematic review and meta-analysis. Phytomedicine. 2020;70:153214.
Woelkart K, Bauer R. The role of Echinacea in prevention and treatment of upper respiratory tract infections. Expert Rev Clin Immunol. 2018;14(4):285–300.
Seca AML, Pinto DCGA. Plant secondary metabolites as anti-inflammatory and antimicrobial agents. Int J Mol Sci. 2018;19(1):263.
WHO. Monographs on Selected Medicinal Plants. Vol. 4. Geneva: World Health Organization; 2020.
EMA. Reflection paper on the use of herbal medicinal products in children and adolescents. EMA/HMPC/342334/2018.
EMA. Guideline on the assessment of herbal medicinal products with reference to safety. EMA/HMPC/32116/2015.
EMA. Public statements on herbal substances and preparations with hepatotoxic pyrrolizidine alkaloids. EMA/INS/216655/2019.
EMA. Community herbal monographs on individual species (2010–2024) – Plantago lanceolata, Althaea officinalis, Hedera helix, Glycyrrhiza glabra, Thymus vulgaris, Echinacea purpurea, Pelargonium sidoides, Salvia officinalis, Allium sativum.
Bradley PR (ed.). British Herbal Pharmacopoeia. Vol. 2. London: BHMA; 2013.
European Pharmacopoeia, 11th Edition. Strasbourg: Council of Europe; 2023.


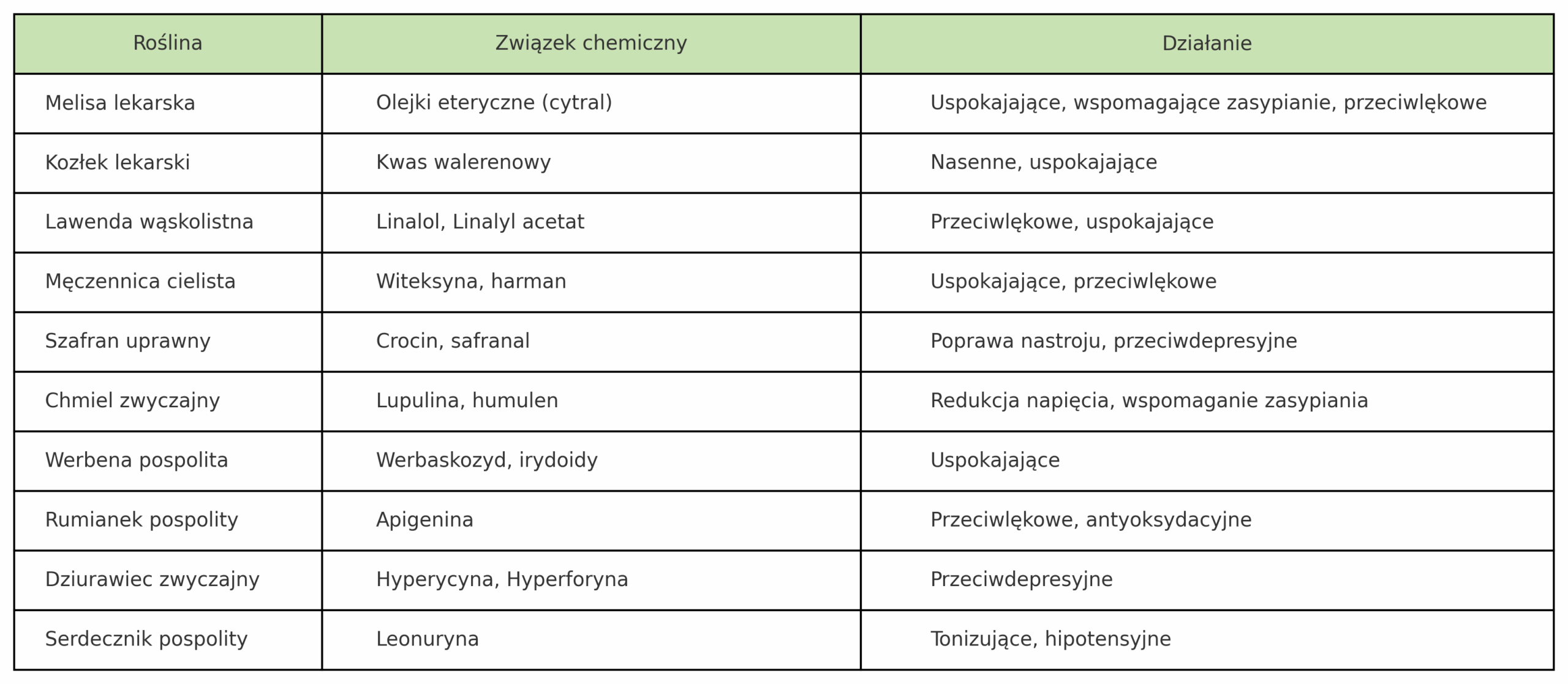
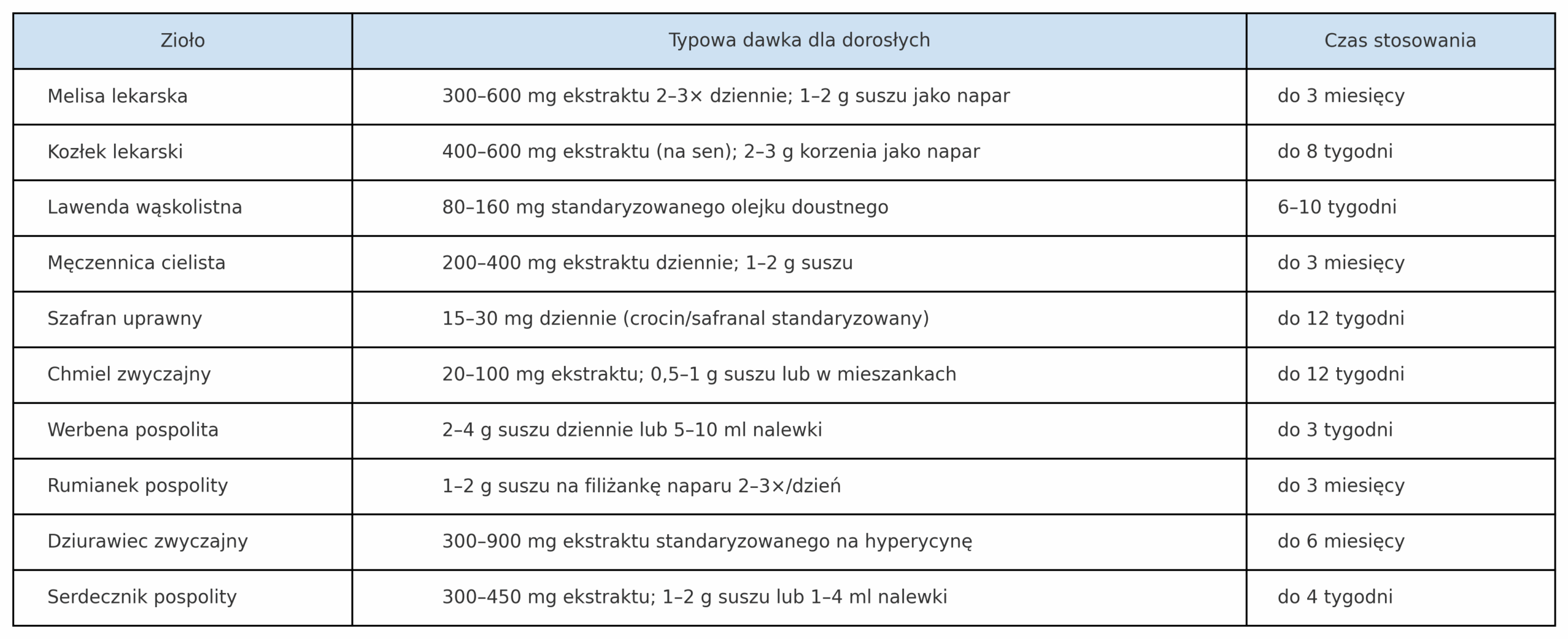
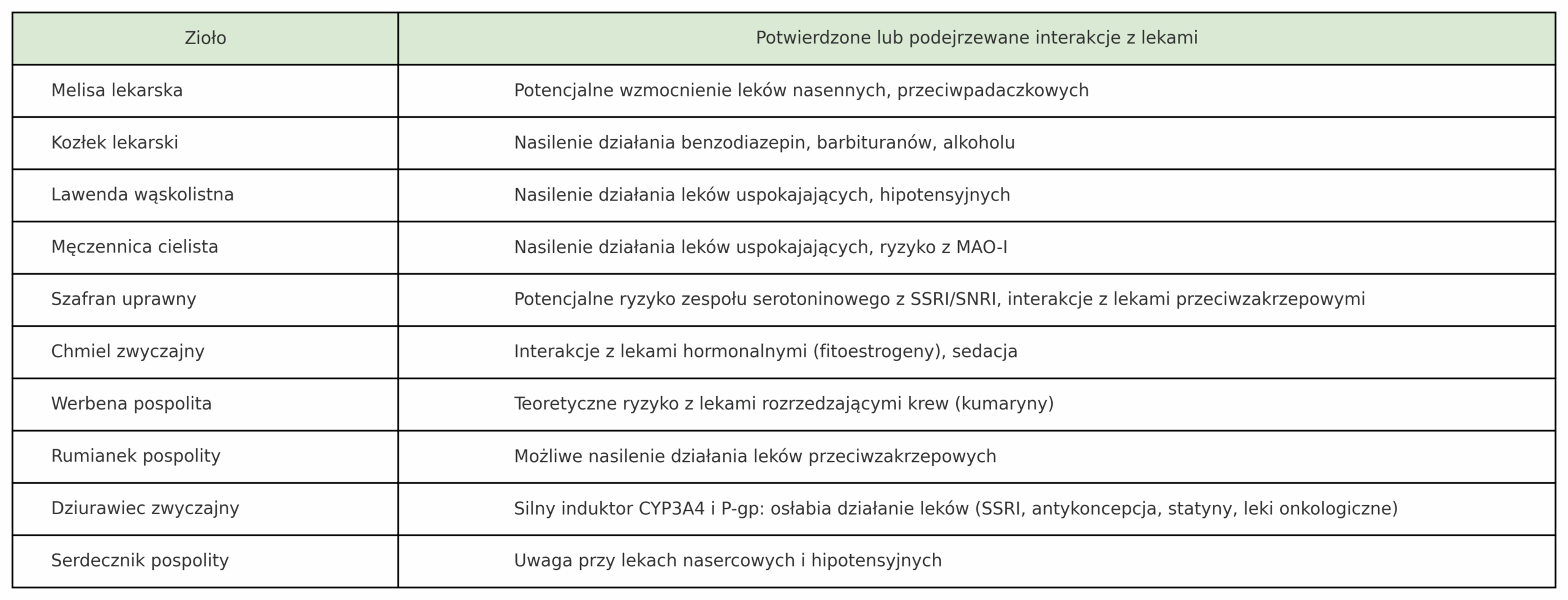
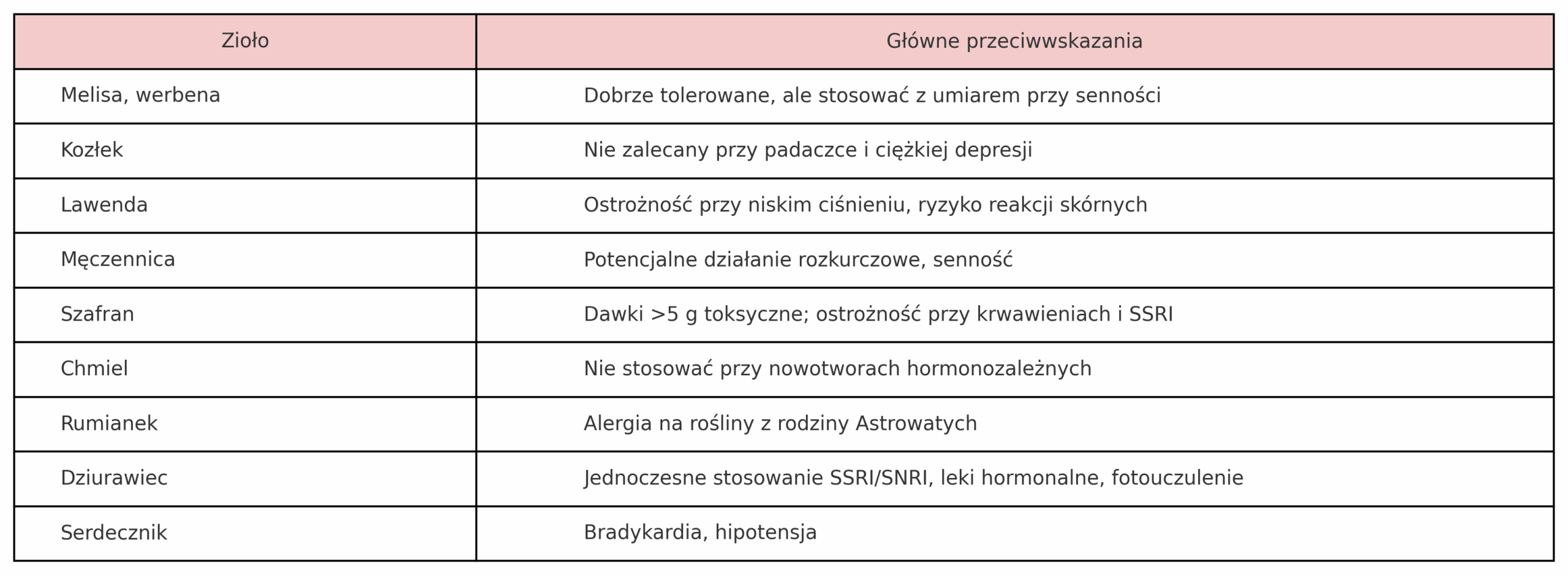
 Komu z nas nie towarzyszy codzienny stres? Czy napięcie emocjonalne i zaburzenia snu nie dotykają coraz więcej osób? Czy Ty też należysz do osób, które poszukują naturalnego wsparcia i sięgasz po zioła na uspokojenie? Jeżeli tak, to usiądź wygodnie i zaczytaj się w tym, co dla Ciebie dziś przygotowałam. Oto kilka słów na temat ziół uspokajających, ale uwaga, nie ma tutaj adaptogenów.
Komu z nas nie towarzyszy codzienny stres? Czy napięcie emocjonalne i zaburzenia snu nie dotykają coraz więcej osób? Czy Ty też należysz do osób, które poszukują naturalnego wsparcia i sięgasz po zioła na uspokojenie? Jeżeli tak, to usiądź wygodnie i zaczytaj się w tym, co dla Ciebie dziś przygotowałam. Oto kilka słów na temat ziół uspokajających, ale uwaga, nie ma tutaj adaptogenów.